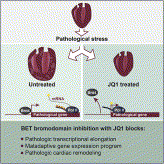
2013年8月4日 讯 /生物谷BIOON/ –凯斯西储大学医学院和Dana-Farber癌症研究中心科学家发现了一条新的与心衰相关的分子通路,并发现药物JQ1能够阻断该分子通路保护心脏免受损伤。
与传统治疗心衰药物不同,JQ1直接作用与细胞的中枢,细胞核,保护细胞免受应激反应的损害。该研究为治疗心衰开辟了一条新的道路。相关研究发表在8月1日Cell杂志上。
该文章的通讯作者Saptarsi Haldar医生说,作为一个临床心脏病医生,我知道面对大量的心衰病人,现有的治疗药物效果非常的差。我们发现的新药直接作用于细胞核,有望能够帮助数以万计的病人脱离疾病的痛苦。
当心脏泵血功能不能达到机体需求的时候就发生心脏衰竭。现有的针对心衰的药物大部分是阻断诸如肾上腺素等激素类药物。但是遗憾的是,多项临床研究表明服用激素阻断剂药物的心衰患者仍然有很高的住院率和死亡率。
科学家在本次研究中发现了一类基因称之为BET,由于该基因的过度活跃导致细胞核产生强烈的应激反应最终导致心脏衰竭。James Bradner博士之前的研究称BET能够引起细胞癌变,并发现了BET的阻断剂JQ1。在癌症模型中,JQ1能够抑制原癌基因功能,防止细胞癌变。而在心衰模型中,JQ1抑制了能够导致心脏破坏的因子。
Jonathan Brown博士称,许多年前我们就知道在心衰过程中细胞核发生异常,但是由于缺少药理学证据,针对细胞核的治疗方法却一直是空白。我们的临床前研究表明JQ1有望成为该方面的药物。
在实验中,科学家每天施予患病小鼠一定剂量的JQ1。一个月后发现治疗小鼠不会出现心脏功能大幅降低现象,较未治疗对照组,治疗小鼠心脏功能提升了60%。
该文章的第一作者Priti Anand博士称,实验结束后,JQ1治疗小鼠心脏明显很健康有力,尽管也经历了持续高强度的压力。
接下来实验中,科学家将继续进行临床前实验,在动物模型中测试心衰和其他心血管疾病。科学家希望尽早进行临床试验阶段。(生物谷Bioon.com)
doi.:10.1016/j.cell.2013.07.013
PMC:
PMID:
BET Bromodomains Mediate Transcriptional Pause Release in Heart Failure
Priti Anand, Jonathan D. Brown, Charles Y. Lin, Jun Qi, Rongli Zhang, Pedro Calderon Artero, M. Amer Alaiti, Jace Bullard, Kareem Alazem, Kenneth B. Margulies, Thomas P. Cappola, Madeleine Lemieux, Jorge Plutzky, James E. Bradner, Saptarsi M. Haldar
Heart failure (HF) is driven by the interplay between regulatory transcription factors and dynamic alterations in chromatin structure. Pathologic gene transactivation in HF is associated with recruitment of histone acetyl-transferases and local chromatin hyperacetylation. We therefore assessed the role of acetyl-lysine reader proteins, or bromodomains, in HF. Using a chemical genetic approach, we establish a central role for BET family bromodomain proteins in gene control during HF pathogenesis. BET inhibition potently suppresses cardiomyocyte hypertrophy in vitro and pathologic cardiac remodeling in vivo. Integrative transcriptional and epigenomic analyses reveal that BET proteins function mechanistically as pause-release factors critical to expression of genes that are central to HF pathogenesis and relevant to the pathobiology of failing human hearts. This study implicates epigenetic readers as essential effectors of transcriptional pause release during HF pathogenesis and identifies BET coactivator proteins as therapeutic targets in the heart.

