近日,METIV-HCC 研究 [1] 结果公布,该研究采用随机、双盲、安慰剂对照的设计,试验组使用 c-MET 抑制剂 Tivantinib 作为干预手段,并将 OS 作为研究的主要终点,旨在探究 Tivantinib 二线治疗 MET 基因高表达肝细胞癌(HCC)的临床疗效。
数年前的 II 期临床研究 [2] 中,尽管 Tivantinib 二线治疗未能显著延长试验组患者的总生存(OS),但在亚组分析中,MET 基因高表达的 HCC 患者能够从 Tivantinib 治疗中显著获益,这也燃起了一些学者对于基因检测指导 HCC 精准治疗的无限期待 [3] 。
作为后续的 III 期治疗研究,METIV-HCC 共入组 368 例 MET 基因高表达的 HCC 患者,然而 Tivantinib 未能延续其在 II 期研究中的表现,这项持续 4 年的 HCC「精准医疗」实践最终折戟沉沙。
近些年来,基因检测和分子靶向药物在多种实体肿瘤中的成功应用似乎宣告着精准医疗时代的到来。那么,精准医疗之于 HCC,我们真的准备好了吗?
准医疗远未成熟 HCC 靶向治疗困难重重
精准医疗目前仍处于临床验证阶段,远未达到临床应用的程度。2016 年 9 月,Nature 与 NEJM 两大顶级期刊先后刊文为精准医学「降温」:对相关研究的综合分析表明,30%~50% 的患者能找到与肿瘤恶化相关的突变基因,仅 3%~13% 能够找到精准治疗的药物,最终能够获益的患者更是少之又少 [4,5] 。
相比于乳腺癌、非小细胞肺癌,HCC 发生、发展的分子机制更为复杂,涉及多条信号通路的改变 [6] ,而这其中每一条信号通路的改变又包含了广泛的基因变异。根据多项研究中对大约 1000 份 HCC 标本进行的深度基因测序分析,每个肿瘤平均有 30~40 个突变,其中 5~8 种可能是 HCC 发生、发展的驱动因子 [7] 。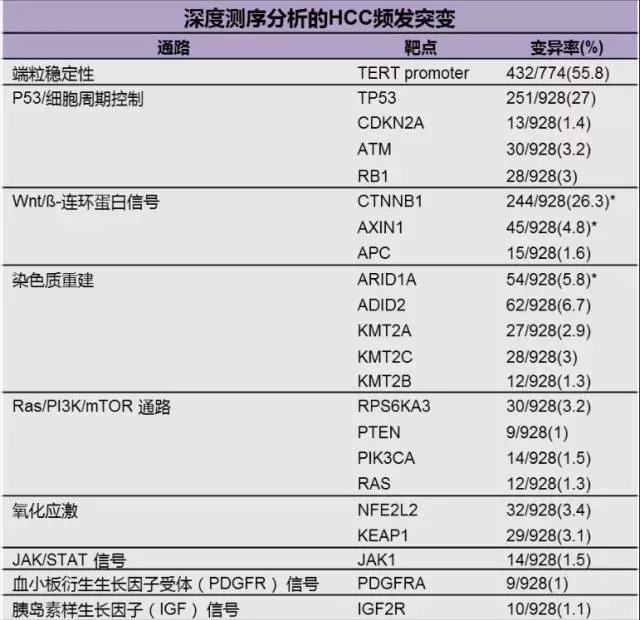
与此同时,HCC 还存在大量肿瘤内和肿瘤间的异质性,目前还不能确定每一个肿瘤的驱动基因是否相同。这种异质性和广泛的基因变异性使得 HCC 的精准医疗困难重重。
自从 SHARP 研究开启 HCC 靶向治疗时代,先后有多种小分子靶向药物或血管生成抑制剂被用于 HCC 的治疗探索,索拉非尼是至今为止唯一被 FDA、CFDA 批准的一线治疗药物;而在二线治疗研究方面,也仅有瑞戈非尼达到了预期的研究终点。
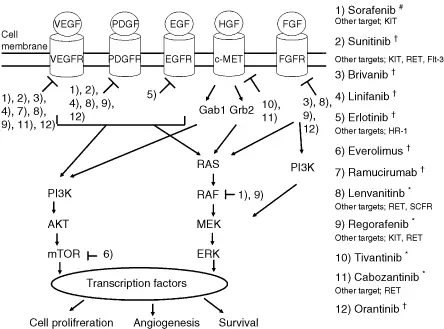
对比其他实体肿瘤靶向治疗药物百花齐放的态势,HCC 治疗领域的成就可谓「惨淡」。但从层层失败中可以窥见的是,同时阻断肿瘤信号网络中的多个关键靶点可能是攻克 HCC 最有前途的做法——在目前应用于 HCC 治疗研究的十余种分子靶向药物中,取得阳性结果的索拉非尼和瑞戈非尼均为多种激酶抑制剂,能够同时作用于 HCC 的 2 条不同信号通路[8] 。
图注:用于肝癌治疗研究的12种分子靶向药物的作用靶点及作用通路
正如前文所述,HCC 发生的分子机制复杂、涉及信号通路多、基因变异性大,单个靶点的治疗药物虽然能够暂时抑制某个信号通路,但其他通路可能出现快速激活或上调,导致肿瘤进展或药物治疗失败 [9] ;而如果考虑单靶点药物的联合治疗,毒性或不良反应的增加又可能影响治疗获益[4] 。
作为一种靶向 c-MET 的单靶点抑制剂,Tivantinib 用于 HCC 治疗研究的失败再度证实,依靠对单个靶点突变的检测来指导药物治疗是错误的选择。精准医疗对于 HCC 是一番看似美好的未来,但鉴于目前对 HCC 分子机制的认识,想要做到这番「精准」还为时尚早。
必须要认识到的一点是,仅仅依靠基因检测进行用药指导并不是真正的精准医疗,这在「篮子试验」的失败中可窥一二。肿瘤的组织特异性、异质性、基因变异性以及肝脏背景病变均需要在治疗中加以考虑,只有经过大规模、随机对照临床研究验证有效的分子靶向药物才能真正使 HCC 患者获益,从这一层面出发,索拉非尼仍是最佳的选择。