透明软骨纤维化通常被认为是骨关节炎的终末期病理特征,可致软骨细胞外基质改变,使组织更加偏向纤维化表型。当透明软骨损伤或退变为纤维软骨时,软骨外基质的主要成分Ⅱ型胶原被Ⅰ型胶原逐步取代。新生的纤维软骨由于缺乏透明软骨的生物和机械特性,不能正常发挥关节软骨的功能。然而,迄今为止,大量的研究集中于软骨降解分子机制的阐明,关于透明软骨纤维化研究仍鲜有报道,其关键分子机制亟待揭示。
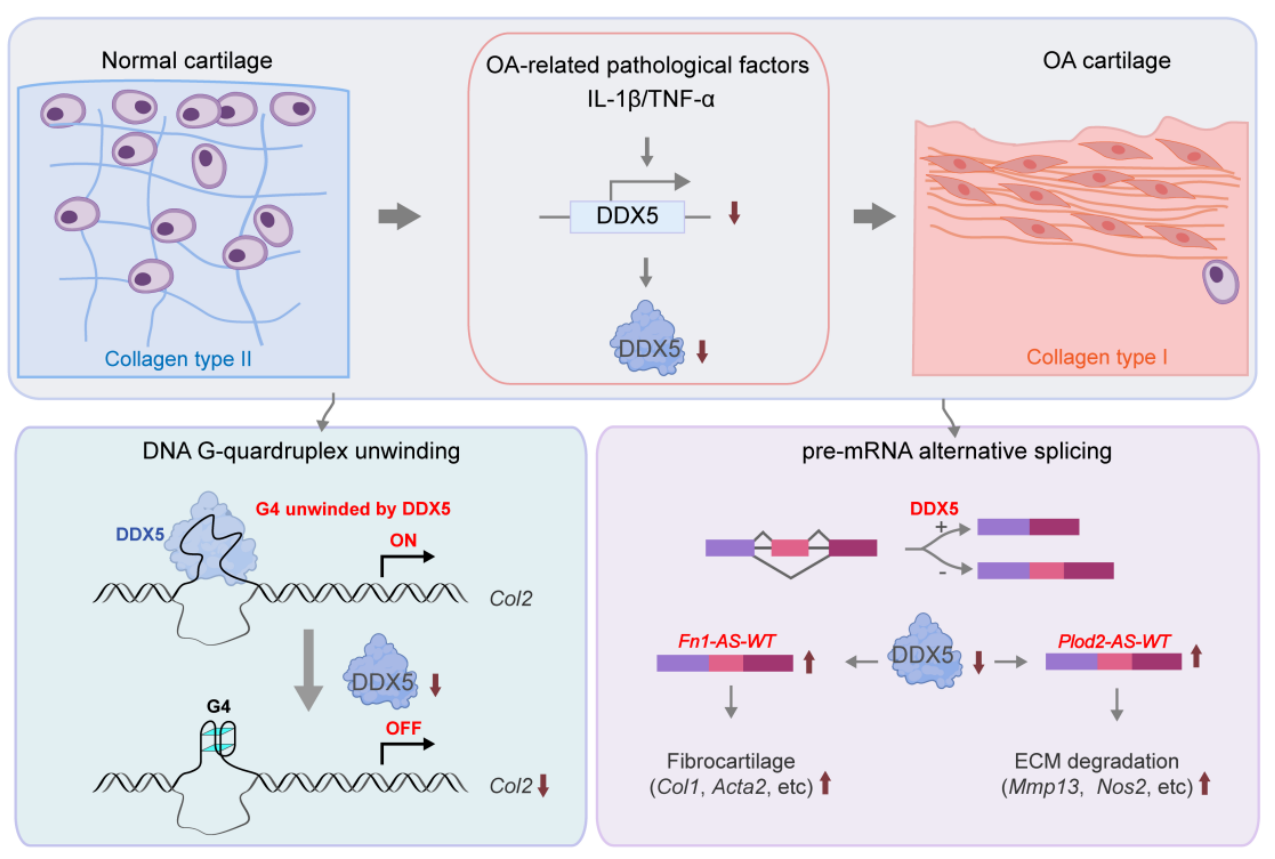
2024年5月17日,我学会抗炎免疫药理专委会主委、南京大学生命科学学院孙洋教授/徐强教授团队在Nature Aging杂志上发表题为DDX5 inhibits hyaline cartilage fibrosis and degradation in osteoarthritis via alternative splicing and G-quadruplex unwinding的研究论文,首次阐明RNA解旋酶DDX5不仅抑制骨关节炎早期软骨退变,还直接阻止了晚期透明软骨的纤维化,该过程是通过选择性剪接和G-四链体解旋双重作用模式所介导,研究人员还借助DDX5基因疗法实现了软骨损伤的逆转。

鉴于软骨与肿瘤微环境均具有乏氧的特征,而肿瘤乏氧微环境下可变剪接发生紊乱,研究人员受此启发,发现了骨关节炎病理条件下细胞外基质相关基因存在差异可变剪接,并筛选参与调控可变剪接的分子发现RNA解旋酶DDX5下调最显著。一方面,DDX5与透明软骨marker COL2表达正相关而与纤维软骨marker COL1负相关,骨关节炎相关病理性刺激因子如IL-1β和TNF-α可致软骨细胞DDX5表达减少;另一方面,敲减DDX5后软骨细胞系ATDC5由圆球型变成长条型的纤维状,一些软骨降解相关基因如MMP13、NOS2、ADAMTS5等表达均上调。进一步构建软骨细胞诱导性DDX5敲除的小鼠,发现DDX5敲除显著加重小鼠DMM骨关节炎造模后的关节损伤,且未造模的DDX5条敲鼠在9月龄会出现自发骨关节炎表型(自发的蛋白多糖丢失、COL1/COL2比例上调以及软骨降解酶高表达)。与之相对,AAV-DDX5腺相关病毒关节腔注射过表达DDX5则可显著改善关节软骨损伤。以上结果综合提示DDX5可能是骨关节炎软骨纤维化及退变进程中的关键分子开关。
进一步研究人员借助RNA-seq及蛋白质组学发现DDX5敲低的ATDC5细胞,其炎症和纤维化等相关通路被显著富集。利用rMATS软件挖掘差异剪接基因,发现DDX5的缺失可导致Fn1和Plod2剪接全长转录本的上调,分别促进纤维软骨表型和细胞外基质的降解,而两个全长转录本的敲减则可显著抑制纤维化及细胞外基质降解相关基因表达,并在体内部分逆转DDX5缺乏诱导的骨关节炎加重表型。然而,有意思的是,Fn1和Plod2全长转录本的敲减并不影响COL2的表达,但DDX5条敲鼠中COL2表达是下调的,提示DDX5可能还存在其他调节COL2表达的机制。
鉴于DDX5作为解旋酶,不仅具有RNA剪接功能,还可以解旋DNA G-四链体(G4)结构。研究人员受此启发,通过核磁共振技术(NMR)筛选Col2启动子689-707区域存在G4特征峰并解析了其为3+1型的拓扑结构,结合ChIP-qPCR实验、免疫荧光以及NMR等多种技术方法验证了DDX5可与Col2-DNA G4结合并解旋其G4,从而促进COL2的表达;而DDX5的缺失致Col2-DNA G4形成使得COL2含量降低,导致透明软骨表型的丧失。
DDX5通过可变剪接和G-四链体解旋双重作用模式阻止透明软骨纤维化和降解的新机制
综上所述,该研究勾勒出DDX5在软骨修复中“既破又立”的双重作用模式:一方面,DDX5通过调控Fn1和Plod2的可变剪接阻止透明软骨纤维化和基质降解(破);另一方面,DDX5还发挥了RNA解旋酶的非经典功能,可直接促进透明软骨编码基因Col2-DNA G-四链体解旋从而增强COL2表达(立)。该研究为洞悉早期软骨退变及晚期纤维化的分子开关以及干预策略提供了重要的线索和思路。
江苏省药理学会秘书处孙东东
2024.6.3

