江苏省药理学会副理事长郝海平教授在Cell子刊、代谢基础研究领域国际顶尖学术期刊《Cell Metabolism》(IF=31)上发表《Psychological stress-induced microbial metaboliteindole-3-acetate disrupts intestinal cell lineagecommitment》,该研究揭示了慢性精神应激诱导肠上皮细胞损伤易感性的脑-肠信号传递与代谢调控新机制,并发现了具有临床监测应用价值的菌群代谢标志物。
现代社会慢性精神心理压力与炎症性肠病、肠易激综合征等肠道疾病高发密切相关。大脑和肠道之间存在一个精确而复杂的调节网络,以增强对环境挑战的综合适应,这种双向的肠-脑连接早已被认为参与了机体的应激反应。最新的研究表明心理压力触发单核细胞介导的肠道炎症从而加剧炎症性肠病(IBD),并揭示了心理压力对肠道炎症影响的机制。目前人们对于精神应激下脑-肠双向信号传递机制,特别是心理压力如何传递并扰动肠道内稳态仍然知之甚少。
围绕以上问题,郝海平教授团队基于前期建立的慢性束缚应激小鼠模型及足底电击模型,发现慢性心理压力暴露会引发不可逆的小肠上皮细胞功能紊乱。通过类器官培养、肠干细胞分化谱系示踪及多组学方法,团队发现以上表型与精神应激下小肠干细胞(ISC)线粒体生物能和功能稳态破坏有关。团队进一步通过化学干预、无菌小鼠、代谢组学及工程菌构建等实验手段发现鼠乳杆菌(L. murinus) 及代谢物吲哚-3-乙酸(IAA)在应激诱导的ISC谱系分化异常中发挥关键作用。后续机制研究表明IAA作为代谢信号抑制ISC线粒体生物能从而以细胞固有的方式破坏其谱系分化、加重肠上皮细胞损伤,而补充三羧酸循环中间体α-酮戊二酸可有效挽救IAA 诱导的体内外损伤。最后,研究团队在患有不同精神困扰的临床患者中证实精神应激下肠道菌群IAA产生能力持续增加并与肠道功能障碍相关。
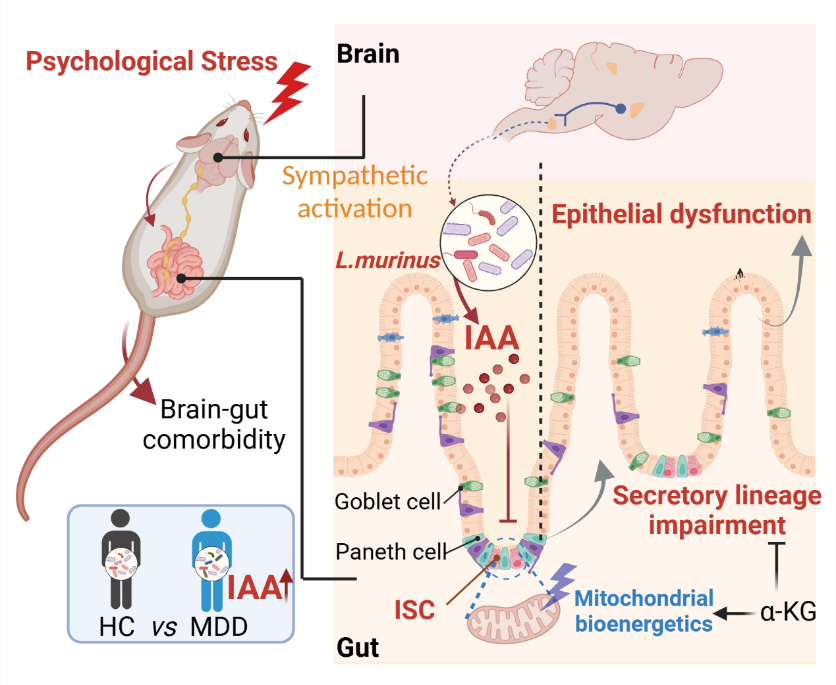
本研究通过宏基因组学、代谢组学、谱系追踪、代谢生物工程和肠道类器官技术,揭示来自大脑的压力信号通过鼠乳杆菌衍生的吲哚-3-乙酸(IAA)作为中介信号,进而阻碍肠道干细胞的线粒体呼吸,从而损害肠道干细胞的命运决定和肠道上皮更新。重要的是,他们还在不同队列的心理困扰患者中验证了这一联系。IAA 在精神抑郁患者的肠道中持续升高,而靶向 IAA 信号被证明可以有效地保护小鼠免受应激的不利影响。总的来说,这些发现揭示了一个由微生物驱动的脑-肠代谢轴,可以用于治疗慢性应激引起的肠-脑共病。为后续开展脑肠轴信号传递、靶标发现及药物精准干预研究提供了新思路与潜在新靶点。
江苏省药理学会秘书处王海丹
2024.1.20

