为支持医院临床主要研究者、质控员及GCP机构管理人员学习现行版《药物临床试验质量管理规范》(GCP)(2020年7月1日起施行)和《医疗器械临床试验质量管理规范》(2022年5月1日起施行),更好地理解并执行国家对临床试验的规范要求,提高药物/医疗器械临床试验技术水平、管理质量和伦理审查水平,保障受试者的权益和安全,培养更多高质量的药物临床研究人员。 2022年6月10日,由江苏省药理学会主办、扬州市中医院协办、江苏省药理学会临床药理专业委员会和江苏法迈生医学科技有限公司承办的“药物临床试验关键技术培训班”顺利在线上举行。本次培训邀请了多名GCP方面的资深专家授课,共约4000人次观看了本次线上直播培训。扬州市中医院药物临床试验机构办公室主任戴小军副主任药师主持了本次会议。

为支持医院临床主要研究者、质控员及GCP机构管理人员学习现行版《药物临床试验质量管理规范》(GCP)(2020年7月1日起施行)和《医疗器械临床试验质量管理规范》(2022年5月1日起施行),更好地理解并执行国家对临床试验的规范要求,提高药物/医疗器械临床试验技术水平、管理质量和伦理审查水平,保障受试者的权益和安全,培养更多高质量的药物临床研究人员。 2022年6月10日,由江苏省药理学会主办、扬州市中医院协办、江苏省药理学会临床药理专业委员会和江苏法迈生医学科技有限公司承办的“药物临床试验关键技术培训班”顺利在线上举行。本次培训邀请了多名GCP方面的资深专家授课,共约4000人次观看了本次线上直播培训。扬州市中医院药物临床试验机构办公室主任戴小军副主任药师主持了本次会议。
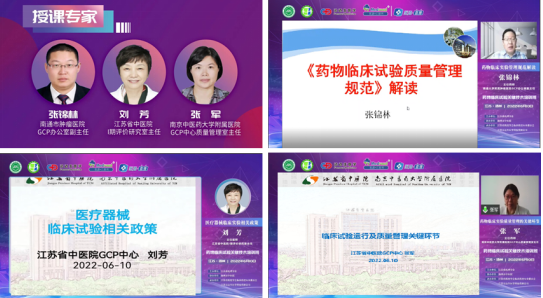
临床药理专委会安排了3位业内知名专家线上授课。临床药理专委会副主任委员、国家、省基地核查员、南通市肿瘤医院GCP办公室副主任张锦林主任药师详细解读了新版《药物临床试验质量管理规范》,并对药物临床试验申办者和研究者的职责进行了重点讨论,申办方承担临床试验注册申报数据全部法律责任,研究者为临床试验数据真实、完整、规范的直接责任人,临床试验机构是间接责任人。江苏省中医院I期评价研究室刘芳主任带领大家学习了医疗器械临床试验相关法规,刘主任先介绍了医疗器械的定义、分类管理及医疗器械临床试验机构的条件和备案管理办法,最后重点解读了2022版《医疗器械临床试验质量管理规范》。南京中医药大学附属医院GCP中心质量管理室张军主任药师做了题为《临床试验运行及质量管理关键环节》的报告,张主任首先介绍了临床试验运行的流程,然后介绍了临床试验运行质量管理的关键环节,最后张主任对临床试验运行常见问题进行了分析。
临床药理专委会安排了3位业内知名专家线上授课。临床药理专委会副主任委员、国家、省基地核查员、南通市肿瘤医院GCP办公室副主任张锦林主任药师详细解读了新版《药物临床试验质量管理规范》,并对药物临床试验申办者和研究者的职责进行了重点讨论,申办方承担临床试验注册申报数据全部法律责任,研究者为临床试验数据真实、完整、规范的直接责任人,临床试验机构是间接责任人。江苏省中医院I期评价研究室刘芳主任带领大家学习了医疗器械临床试验相关法规,刘主任先介绍了医疗器械的定义、分类管理及医疗器械临床试验机构的条件和备案管理办法,最后重点解读了2022版《医疗器械临床试验质量管理规范》。南京中医药大学附属医院GCP中心质量管理室张军主任药师做了题为《临床试验运行及质量管理关键环节》的报告,张主任首先介绍了临床试验运行的流程,然后介绍了临床试验运行质量管理的关键环节,最后张主任对临床试验运行常见问题进行了分析。
最后,戴小军主任作总结发言,他表示培训班内容丰富,专家们授课精彩,他代表扬州市中医院向江苏省药理学会、江苏省药理学会临床药理专委会和江苏法迈生医学科技有限公司表示感谢。培训讲座结束后,参会学员们在规定时间内进行了相关知识的结业考核。此次培训班赢得学员们的一致认可,让他们对药物和医疗器械的临床试验质量管理规范有了更深入的认识,对积极准备药物临床试验资格备案和今后如何开展药物及医疗器械临床试验有了更深入的理解和帮助!
江苏省药理学会秘书处 许美娟
2022.6.10

